- HOME
- C型肝炎の治療
C型肝炎の治療について
C型肝炎治療ガイドライン第8.2版改訂を公表(2023年1月)
現在、直接型抗ウイルス薬(DAA)によるIFNフリー抗ウイルス治療の有効性は極めて高く、初回投与例でのウイルス排除率は約99%となっています。
今回の改訂第8.2版では、グレカプレビル/ピブレンタスビル(GLE/PIB)の3歳以上12歳未満小児への適応追加、およびソホスブビル/ベルパタスビル(SOF/VEL)の代償性肝硬変・慢性肝炎への適応追加を受け、推奨・治療フローチャートが変更されています。
1.C型慢性肝炎・代償性肝硬変*1 *2 *3 (DAA治療歴なし)
・SOF/LDV(ハーボニー)
・GLE/PIB(マヴィレット)
・SOF/VEL(エプクルーザ)
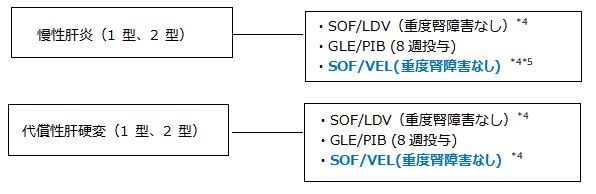
*1 高齢者、肝硬変・線維化進展例などの高発癌リスク群は早期に抗ウイルス療法を行う。
*2 1型と2型の混合感染に対しては、pangenotypeに有効なGLE/PIB、SOF/LDVないしSOF/VELで治療する。
*3 ソホスブビル/ベルパタスビル配合錠(エプクルーザ)以外のIFNフリーレジメンはChild-Pugh分類grade BまたはCの症例には禁忌、ないし使用すべきではない。
*4 重度の腎機能障害(eGFR<30mL/分/1.73m2)又は透析を必要とする腎不全の患者に対するSOFの投与は禁忌である。
*5 本邦における慢性肝炎への臨床試験は行われていない。
2.慢性肝炎・代償性肝硬変*1(プロテアーゼ阻害薬+Peg-IFN+RBV による前治療不成功例)
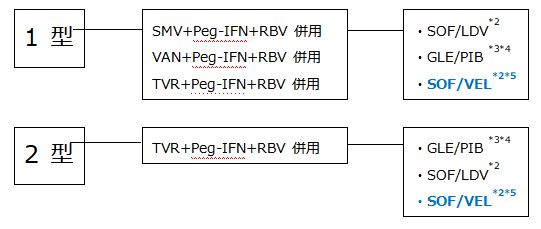
*1 ソホスブビル/ベルパタスビル配合錠以外のIFN フリーレジメンはChild-Pugh分類grade BまたはCの症例には禁忌、ないし使用すべきではない。
*2 重度の腎機能障害(eGFR<30mL/分/1.73m2)又は透析を必要とする腎不全の患者に対するSOFの投与は禁忌である。
*3 国内臨床試験におけるGLE/PIBの投与期間は、DAA治療歴のある慢性肝炎ならびに代償性肝硬 変では12週間である。
*4 プロテアーゼ阻害薬+Peg-IFN+RBV前治療により誘導されたNS3変異の影響についてのエビデンス はない。
*5 本邦における慢性肝炎への臨床試験は行われていない。
3.慢性肝炎・代償性肝硬変*1*2(IFNフリーDAA 前治療不成功例)
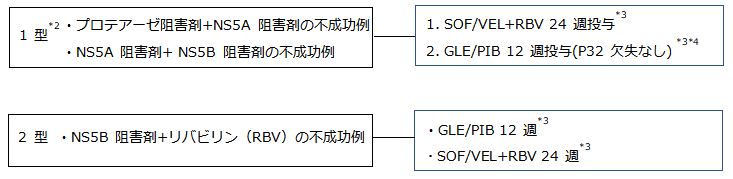
*1 非代償性肝硬変に対する GLE/PIB 治療の安全性と有効性は確認されていない。RBV 投与は 禁忌であることから SOF/VEL+RBV も投与すべきではない。
*2 ゲノタイプ1型に対してIFNフリーDAAによる前治療を行い不成功となった例では、L31やY93以 外にP32欠失やA92などNS5A領域に多彩な変異が出現し、NS5A阻害薬の治療効果低下に関与する可能性がある。ことにP32欠失はNS5A阻害薬に対して強い耐性を示す。従って、DAA前治療不成功例に対する再治療を検討する際には、NS3/4AならびにNS5A領域の薬剤耐性変異、ことにP32欠失の有無を測定した上で、肝臓専門医により慎重な治療薬選択がなされることを推奨する。
*3 GLE/PIB12週治療不成功例に対ししてはSOF/VEL+RBV24週、SOF/VEL+RBV24週不成功例に対してはGLE/PIB12週が治療選択肢となるが、臨床試験においても実臨床においてもその有効性は確認されておらず、肝臓専門医により慎重な治療薬選択がなされることを推奨する。
*4 P32欠失例に対するGLE/PIB12週の治療効果は極めて低いため、ゲノタイプ1型に対する同治療はP32欠失がないことを確認してから施行することを推奨する。
4.C型非代償性肝硬変*1
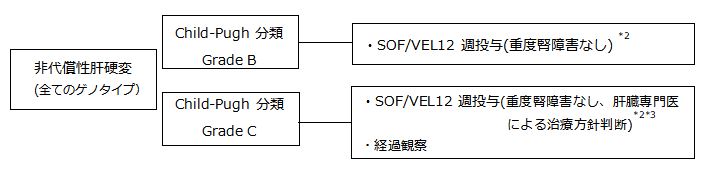
*1 DAA治療不成功例への再治療の場合、SOF/VEL+RBV24週間投与は施行すべきではなく、肝臓専門医の判断においてSOF/VEL12週間投与を選択肢とする。
*2 重度の腎機能障害(eGFR<30mL/分/1.73m2)又は透析を必要とする腎不全の患者に対するSOFの投与は禁忌である。
*3 Child-Pugh分類grade C(とくにChild-Pughスコア13~15点)症例に対する同薬剤の安全性は十分に検証なされていない.したがって、SOF/VEL投与については、肝臓専門医によって治療方針が決定されるべきであり、投与の場合には極めて慎重な経過観察が望ましい。
【出典元】『C型肝炎治療ガイドライン』2023年1月 第8.2版![]()
※Adobe Acrobat ReaderがないとPDF閲覧できません。
C型肝炎治療ガイドライン第8.1版改訂を公表(2022年5月)
現在、直接型抗ウイルス薬(DAA)によるIFNフリー抗ウイルス治療の有効性は高く、初回投与例でのウイルス排除率は95%以上となっています。今回の改訂第8.1版では、ダクラタスビル+アスナプレビル併用療法、エルバスビル+グラゾプレビル併用療法、ソホスブビル+リバビリン併用療法を各薬剤の販売中止に伴い治療推奨から削除し、推奨・治療フローチャートの改訂を行いました。また、C型肝炎に対する抗ウイルス治療の対象の記載を改訂いたしました。
1.C型慢性肝炎・代償性肝硬変*1 *2 *3 (DAA治療歴なし)
・SOF/LDV(ハーボニー)
・GLE/PIB(マヴィレット)
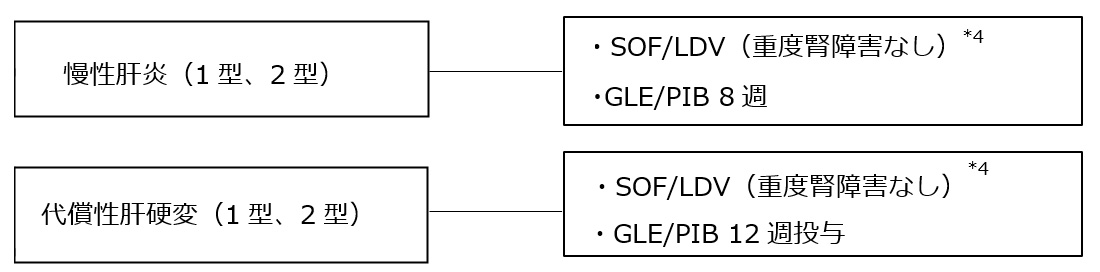
*1 高齢者、肝硬変・線維化進展例などの高発がんリスク群は早期に抗ウイルス療法を行う。
*2 1型と2型の混合感染に対しては、pangenotypeに有効なGLE/PIBないしSOF/LDVで治療する。
*3 ソホスブビル/ベルパタスビル配合錠(エプクルーザ)以外のIFNフリーレジメンはChild-Pugh分類gradeBまたはCの症例には禁忌、ないし使用すべきではない。DAA治療歴のない代償性肝硬変に対するソホスブビル/ベルパタスビル配合錠の保険適用はない。
*4 重度の腎機能障害(eGFR<30mL/分/1.73m2)又は透析を必要とする腎不全の患者に対するSOFの投与は禁忌である。
2.慢性肝炎・代償性肝硬変*1*2 (IFNフリーDAA前治療不成功例)
・SOF/VEL(エプクルーザ)
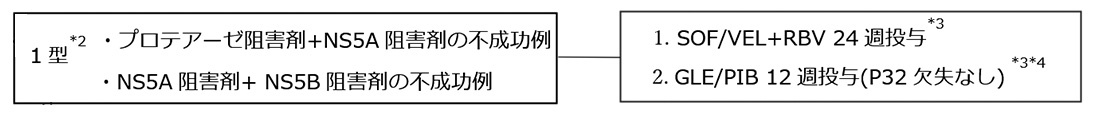
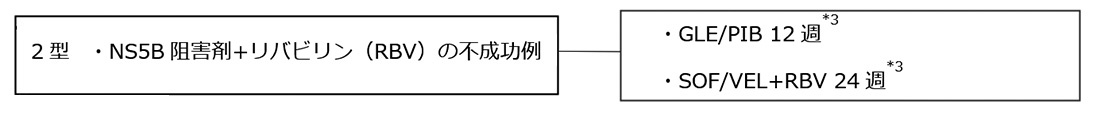
*1 非代償性肝硬変に対するGLE/PIB治療の安全性と有効性は確認されていない。RBV投与は禁忌であることからSOF/VEL+RBVも投与すべきではない。
*2 ゲノタイプ1型に対してIFNフリーDAAによる前治療を行い不成功となった例では、L31やY93以外にP32欠失やA92などNS5A領域に多彩な変異が出現し、NS5A阻害薬の治療作用低下に関与する可能性がある。ことにP32欠失はNS5A阻害薬に対して強い耐性を示す。従って、DAA前治療不成功例に対する再治療を検討する際には、NS3/4AならびにNS5A領域の薬剤耐性変異、ことにP32欠失の有無を測定した上で、慎重な治療薬選択がなされることを推奨する。
*3 GLE/PIB 12週治療不成功例に対してはSOF/VEL+RBV 24週、SOF/VEL+RBV 24週不成功例に対してはGLE/PIB 12週が治療選択肢となるが、臨床試験においても実臨床においてもその有効性は確認されておらず、慎重な治療薬選択がなされることを推奨する。
*4 P32欠失例に対するGLE/PIB 12週の治療作用は低いため、ゲノタイプ1型に対する同治療はP32欠失がないことを確認してから施行することを推奨する。
3.C型非代償性肝硬変*1
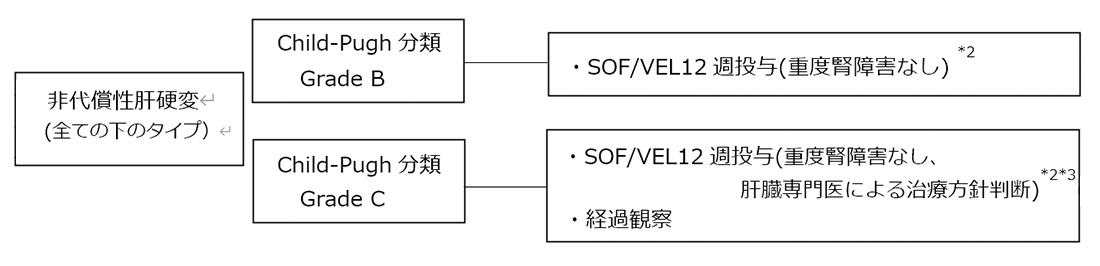
*1 DAA治療不成功例への再治療の場合SOF/VEL+RBV 24週間投与は施行すべきではなく、SOF/VEL 12週間投与を選択肢とする。
*2 重度の腎機能障害(eGFR<30mL/分/1.73m2)又は透析を必要とする腎不全の患者に対するSOFの投与は禁忌である。
*3 Child-Pugh分類grade C(特にChild-Pughスコア13~15点)症例に対する同薬剤の安全性は十分に検証なされていない。したがって、SOF/VEL投与には極めて慎重な経過観察が望ましい。
【出典元】『C型肝炎治療ガイドライン』2022年5月 第8.1版![]()
※Adobe Acrobat ReaderがないとPDF閲覧できません。
C型肝炎治療ガイドライン第7版改訂を公表(2019年8月)
2019年1月に非代償性肝硬変やDAA前治療不成功例に対する新規経口抗ウイルス薬「エプクルーサ配合錠」(一般名:ソホスブビル(SOF)/ベルパタスビル(VEL))が承認されました。日本肝臓学会は、これに伴いC型肝炎治療ガイドライン第7版(2019年6月)を公表。このなかで本剤の非代償性肝硬変例とDAA前治療不成功例に対する臨床試験成績・薬剤特性に対する記載、ゲノタイプ1型DAA前治療不成功例に対する治療推奨の変更、非代償性肝硬変に対する治療の追加が行われています。
C型慢性肝炎・代償性肝硬変(IFNフリーDAA治療歴なし)の第一選択薬は、
ゲノタイプ1型では①ハーボニー(SOF/LDV)、重度腎障害なし②グラジナ・エレルサ(EBR/GZR)③マヴィレット(GLE/PIB)の3種
ゲノタイプ2型では①ソホスブビル+リバビリン(SOF/RBV、重度腎障害なし)②マヴィレット③ハーボニー(重度腎障害なし)の3種
ゲノタイプ1型と2型混合感染例ではマヴィレットないしハーボニーが推奨
C型慢性肝炎・代償性肝硬変(IFNフリーDAA前治療不成功例)の第一選択薬は、
ゲノタイプ1型(NS3阻害剤/4A+NS5A阻害剤またはNA5A阻害剤+NS5B阻害剤不成功例)・ゲノタイプ2型(NS5B阻害剤+RBV不成功例)では①マヴィレット(GLE/PIB)12週 ②エプクルーサ配合錠(SOF/VEL)+RBV24週
当院も参加している九州大学関連病院研究(KULDS)からDAA前治療不成功例に対するマヴィレット(GLE)/(PIB)12週の治療成績が報告されています(Hepatology Research 2019;49:617-626)。ゲノタイプ1型では100%(20/20)(ASV/DCV不成功例(15/15)・LDV/SOF不成功例(5/5))、ゲノタイプ2型SOF/RBV治療不成功例に対して100%(20例中20例)著効が得られています。
但し、DAAによる前治療不成功例には多彩な変異が出現し、ことにP32欠損はNA5A阻害薬に対し強い耐性を示し、P32欠損以外の変異も治療作用低下に関与する可能性があり、DAA前治療不成功例に対する再治療を検討する際にはNA3/4AならびにNS5A領域の薬剤耐性変異、ことにP32欠失の有無を測定した上で、慎重な治療薬選択がなされることが推奨されています。
C型非代償性肝硬変(すべてのゲノタイプ)の第一選択薬は、エプクルーサ配合錠(SOF/VEL)12週のみ。
DAA治療不成功例への再治療はSOF/VEL12週間投与を選択肢とする。重度の腎障害者はSOFの投与は禁忌である。Child-Pughスコア13点以上の症例に対する同薬剤の安全性は十分に検証されてなく、極めて慎重な経過観察が望ましいとされています。
【出典元】『C型肝炎治療ガイドライン』2019年6月 第7版
C型肝炎治療ガイドライン第6版一部改訂(2018年11月)
日本肝臓学会は2017年12月14日に公表した『C型肝炎治療ガイドライン』第6版の改訂版を2018年3月と10月にそれぞれ第6.1版、6.2版として公表しています。C型慢性肝炎・代償性肝硬変(IFNフリーDAA治療歴なし)の第一選択薬は、
ゲノタイプ1型では①ハーボニー(ソホスブビル(SOF)/レジパスビル(LDV)、重度腎障害なし)②グラジナ・エレルサ(エルバスビル(EBR)+グラゾプレビル(GZR))③マヴィレット(グレカプレビル(GLE)/ピブレンタスビル(PIB))の3種
ゲノタイプ2型では①ソホスブビル+リバビリン(SOF/RBV、重度腎障害なし)②マヴィレット③ハーボニー(重度腎障害なし)の3種
ゲノタイプ1型と2型混合感染例ではマヴィレットが推奨
C型慢性肝炎・代償性肝硬変(IFNフリーDAA治療歴あり)の第一選択薬は、
ゲノタイプ1型では①マヴィレットのみ
ゲノタイプ2型ではSOF/RBV治療不成功例に対してはマヴィレットが有効である可能性があるがエビデンスがないとされていますが、九州大学関連病院研究(KULDS)からの報告(Hepatology Research 2019;49:617-626)では100%(20例中20例)著効が得られています。
C型慢性肝炎・代償性肝硬変(CKD4以上の重度腎機能障害合併)の第一選択薬は、
ゲノタイプ1型では①グラジナ・エレルサ②マヴィレット
ゲノタイプ2型では①マヴィレットのみ
C型肝炎治療ガイドライン第6版を公表-IFNベース治療を推奨しない(2018年1月)
日本肝臓学会は『C型肝炎治療ガイドライン(GL)』を改訂し、2017年12月14日に第6版を公表しました。IFNフリー直接作用型抗ウイルス薬(DAA)の有効性
2017年9月にゲノタイプ(GT)1〜6全てのC型肝炎に使用可能(パンジェノタイプ)な新規の経口DAAグレカプレビル(GLE)/ピブレンタスビル(PIB)が承認されたことを機に今回の改訂が行われました。
マヴィレット(GLE/PIB)および既存のIFNフリーDAAは、初回治療例、IFN既治療例ともに98%以上、ほぼ全例でHCVの排除が可能となっています。『C型肝炎治療ガイドライン(第6.2版)2018年10月』さらに、IFNフリーDAAで最初に登場したダクラタスビル+アスナプレビル(DCV+AV)併用治療の不成功例に対しても一定の有効性が得られることが明らかになりました。
また、IFNフリー治療によるHCV排除後にIFN治療と同等の発がん抑止作用が得られるかどうかについても、肯定的な報告が増えつつあります。そのためGL第6版では、C型肝炎に対する抗ウイルス治療においてIFNフリー治療を行うことを原則とし、IFNフリーDAA治療不成功例における多剤耐性獲得などの特殊な場合を除いてIFNベースの治療は推奨しないこととしました。
いずれの治療もGLE/PIBが推奨に
今回の改訂により、慢性肝炎、代償性肝硬変などいずれの治療フローチャートにも(GT1、GT2とも)推奨治療にマヴィレットが加えられました。
C型慢性肝炎・代償性肝硬変(IFNフリーDAA治療歴なし)の第一選択薬は、
ゲノタイプ1型では①ハーボニー(ソホスブビル(SOF)/レジパスビル(LDV)、重度腎障害なし)②グラジナ・エレルサ(エルバスビル(EBR)+グラゾプレビル(GZR))③マヴィレットの3種
ゲノタイプ2型では①ソホスブビル+リバビリン(SOF/RBV、重度腎障害なし)②マヴィレットの2種
ゲノタイプ1型と2型混合感染例ではマヴィレットが推奨
C型慢性肝炎・代償性肝硬変(IFNフリーDAA治療歴あり)の第一選択薬は、
ゲノタイプ1型では①マヴィレットのみ
DCV+ASV併用不成功例に対しては、マヴィレットの著効率93%(28/30)に対しハーボニー治療では市販後の治療成績での著効率60~70%と報告されており『C型肝炎治療ガイドライン(第6.2版)2018年10月』、第一選択はマヴィレットとされています。マヴィレット治療が不成功だった2例はNS5A領域P32欠失が認められ、P32欠失はDCV+ASV併用治療不成功例の5%程度に検出されると報告されていることから、治療前に薬剤耐性変異、ことにP32欠失の有無を測定することが望ましいとされました。
ゲノタイプ2型ではSOF/RBV治療不成功例に対してはマヴィレットが有効である可能性があるが現時点ではエビデンスがないとされました。
C型肝炎治療薬-マヴィレット配合錠登場~最短で8週間の治療も~(2017年12月17日)
2017年11月27日C型肝炎治療薬マヴィレット配合錠(グレカプレビル水和物/ピブレンタスビル)が発売されました。最短8週間の治療、ジェノタイプ1型、2型をはじめ3~6のパンジェノタイプのC型肝炎患者に有効で、過去の直接作用型抗ウイルス薬(DAA)で治っていない患者や透析を含む腎障害患者にも適応があることが特徴的です。肝硬変がない直接作用型抗ウイルス薬未治療のジェノタイプ1型、2型のC型肝炎ウイルス(HCV)感染患者の治療期間は8週間に短縮され、臨床試験でのウイルス学的著効率は約99%(n=226/229)でした。重度の腎障害に対しても8週間の治療で著効率は100%(10/10)。一方、肝硬変患者、DAAによる前治療で治っていない患者、ジェノタイプ3~6のC型肝炎に対しては12週間の治療です。肝硬変患者の著効率は100%(58/58)、DAAによる前治療で治っていない患者の著効率は93.9%(31/33)、ジェノタイプ3~6型患者の著効率は83.3%(10/12)。臨床試験での副作用は(臨床検査異常を含む)は332例中80例(24.1%)に認められ、主な副作用は、そう痒症16例(4.8%)、頭痛14例(4.2%)、倦怠感10例(3.0%)および血中ビリルビン増加8例(2.4%)で、重篤な副作用はみられませんでした。これまでのDAA療法は、ジェノタイプ、ウイルス耐性の有無、併用薬または透析など、患者さんの状態によりDAA療法を使い分けていましたが、マヴィレットの登場により1つの治療レジメンでそのほとんどがカバーされることになります。
C型肝炎治療薬-マヴィレット配合錠登場~最短で8週間の治療も-(2017年12月17日)
【出典元】『C型肝炎治療ガイドライン』2017年12月 第6版
進歩したC型肝炎治療―4番目のDAA新薬グラジナ・エレルサ(2017年1月9日)
ジェノタイプ1型のC型肝炎に対し直接作用型抗ウイルス薬(DAA)によるインターフェロン(IFN)フリー経口薬治療が広く行われています。2014年にダクラタスビル/アスナプレビル(ダクルインザ/スンベプラ)、2015年にソホスブビル/レジパスビル(ハーボニー)とオムビタスビル/パリタプレビル/リトナビル(ヴィキラックス)が発売されて1年以上経過し、実臨床で治療作用を発揮しています。2016年11月に1型の経口治療薬としては、第4番の新薬であるグラゾプレビル・エルバスビル(グラジナ・エレルサ)が発売されました。グラゾプレビルはNS3/4Aプロテアーゼ阻害剤、エルバスビルはNS5A阻害薬であり、ダクルインザ/スンベプラとヴィキラックスと同じDAA製剤の組み合わせです。因みにハーボニーはNS5AとNS5Bの配合剤です。 【出典元】『C型肝炎治療ガイドライン』2016年12月 第5.2版
グラジナ・エレルサの国内第III相臨床試験の対象はジェノタイプ1でC型慢性肝炎患者336例(代償性肝硬変35例を含む)。全患者のSVR12率(投与終了12週目のHCVRNA持続陰性化率)は97.8%で、慢性肝炎患者で96.5%、代償性肝硬変患者で97.1%。治療歴、性別、IL28B遺伝子の一塩基多型(SNP)などの背景因子別に解析しても95%以上のSVR12率が得られています。耐性変異別のSVR12率の検討でもNS3領域に耐性変異を有する患者では、NS5A領域耐性変異を有する患者では93.1%のSVR12率が得られています。
日本の治験ではありませんが、海外では透析患者を含む重度腎機能障害患者(eGFR=30mL/min/1.73m2未満)に対する臨床試験も行われており、SVR12率99.1%が得られています。
DAA製剤は種々の薬物と相互作用があります。グラジナ・エレルサにも併用禁忌や併用注意の薬剤もありますが、高齢者で多く使われているCa拮抗薬や、プロトンポンプ阻害薬やH2受容体拮抗薬といった胃酸分泌抑制薬などの薬物とは相互作用はみられません。現在DAA製剤で多く使われているハーボニーと比較すると腎機能低下者や逆流性食道炎などで胃酸分泌抑制薬を減量または中止ができない患者さんには本剤が問題なく使用できる治療薬であるといえるのかもしれません。
第20回日本肝臓学会大会から(2016年11月4日神戸)
当院から多数の患者さんを登録している九州大学関連肝疾患治療研究会(KULDS)から「C型慢性肝炎に対するソホスブビル併用治療の実臨床成績- 多施設共同研究 -」Genotype 1型に対するソホスブビル/レディパスビル(ハーボニー)療法および2型に対するソホスブビル(ソバルディ)とリバビリン療法の有効性と安全性について、2016年5月の日本肝臓学会総会での報告から症例数を増加し総数1000例以上を集計し再度報告されました。
対象はSVR12(治療終了後12週のウイルス学的著効)率の判定ができた患者(1型772例、2型446例)。
Genotype 1型に対するソホスブビル/レディパスビル療法については、SVR12率は98.8%(763/772)と高率でした。慢性肝炎は99.8%(550/551)、肝硬変は96.4%(213/221)。NS5A変異(L31 or Y93)なしは99.6%(559/561)、変異ありは96.1%(174/181)。治療作用に関連する因子はNS5A変異(L31 or Y93)と肝硬変でした。肝硬変群において、治療前のNS5A変異を有する場合、SVR12率 88.7%(47/53)で、NS5A耐性変異なし98.8%(158/160)と比較して有意に低率でした。特記すべき重篤な有害事象は少なく、治療中止は5例のみ(0.6%)でした。
一方、Genotype 2型に対するソホスブビルとリバビリンのSVR12率は95.7%(427/446)。慢性肝炎では97.5%(347/356)、肝硬変では88.9%(80/90)。リバビリン併用既治療では91.7%(132/144)で、初回治療97.7%(295/302)と比較して有意に高率でした。
SVR12に関連する因子は、初回治療および非肝硬変でした。既治療かつ肝硬変症例において、SVR12率は82.5%(33/40)と有意に低率であった。
副作用は貧血が最も多く、10.6%でHb<10g/dLの貧血が認められました。しかし、リバビリンを減量することで治療完遂が可能でした。
貧血以外の重篤な有害事象は殆ど認めず、治療中止は僅かに3例(0.7%)のみでした。
以上から、ソフォスビル併用治療は1型、2型ともに有効性は非常に高く、重篤な有害事象や治療中止は少数でした。1型・2型ともに、非著効例は肝硬変症例でした。
